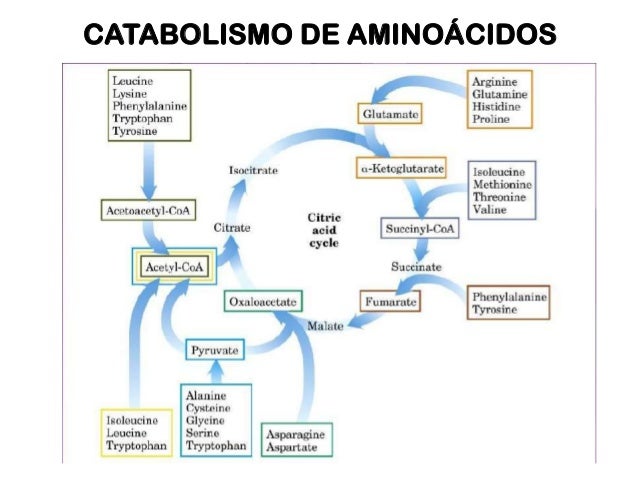
Catabolismo de aminoácidos
Los aminoácidos inician
su degradación por procesos que separan el grupo α-amina
Procesos de separación
del grupo α-amina:
-
Desaminación: separa el
grupo amina
-
Transaminación:
transfiere el grupo amina
TRANSAMINACIÓN
- Transferencia del grupo α-amina de un aminoácido a un α-cetoácido.
- El aminoácido se
convierte en cetoácido y el cetoácido aceptor del grupo amina en aminoácido
- Esquema general
- Esquema general
- La enzima
aminotransferasa usa de coenzima al piridoxal fosfato (derivado de piridoxina,
vitamina del complejo B).
-
El piridoxal fosfato
forma con el aminoácido un compuesto intermediario: base de Schiff.
-
El piridoxal fosfato
sirve de aceptor sirve de aceptor y transportador del grupo amina.
RESUMEN:
-
Por hidrólisis se desprende el α-cetoácido
correspondiente al aa. Original
-
El grupo
prostético de la enzima queda convertido en piridoxamina fosfato
-
Ingresa al
sitio catalítico el α-cetoácido que forma base de Schiff con
piridoxamina fosfato
- Esta reacción es importante en el hígado
- El oxalacetato actúa como aceptor del grupo
amina, cedido por glutamato
- Aspartato actúa como donante de nitrógeno en la síntesis de la urea
- Alanina es portador de amina
- La ASP y ALP son abundantes en hígado y corazón
- Alanina y aspartato formados a partir de piruvato y oxalacetato, reaccionan con α-cetoglutarato
- Los grupos amina son
catalizados hacia la formación de glutamato
DESAMINACIÓN
- El α-cetoglutarato es el sustrato más frecuente en la transaminaión → se forma glutamato.
- El grupo nitrogenado del glutamato puede ser separado por desaminación oxidativa catalizada por glutamato deshidrogenasa (Matriz mitocondrial) → se forma α-cetoglutarato y amoniaco.
- Glutamato deshidrogenasa es una enzima alostérica, activada por ADP y GDP e inhibida por ATP y GTP
- ↑producción α-cetoglutarato alimenta el funcionamiento del ciclo de
Krebs y genera ATP.
- Mucho ATP y GDP ↓el
aporte de α-cetoglutarato (inhibe
glutamato deshidrogenasa).
- La reacción es reversible, glutamato deshidrogenasa actúa en la vía catabólica y síntesis de glutamato
- Otras enzimas catalizan la desaminación oxidativa de aminoácidos (flavoproteínas): aminoácido oxidasas.
Degradación de aminoácidos
-
Los aa. Destinados al
metabolismo energético deben desaminarse para proporcionar el esqueleto
carbonado.
-
Tres mecanismos para la
eliminación del grupo amino:
· Transaminación:
Transferencia del grupo amino a un aceptor cetoácido
· Desaminación oxidativa:
Eliminación oxidativa del grupo amino, produce cetoácidos y amoniaco
· Eliminación de una
molécula de agua por una deshidratasa: produce un intermediario imina, se
hidroliza para producir α-cetoglutarato y amoniaco
Transaminación:
- Principal mecanismo para
eliminación de grupos amino de los aa.
- Transferencia del grupo
amino desde aa. Hasta un α-cetoácido aceptor
- Aminotransferasas o
transaminasas, eliminan el grupo amino de los aa. Y producir α-cetoácido
- Las aminotransfersas
utilizan fosfato de piridoxal (Cofactor derivado de la vitamina B6,
piridoxina)
- Los dos átomos de
nitrógeno se incorporan en la urea a partir de glutamato y aspartato
- El amoniaco que procede
del glutamato por acción de la glutamato deshidrogenasa (GDH), entra en el
ciclo de urea como carbamoil fosfato.
- Un segundo método de desaminación sólo es posible para los hidroxiaminoácidos (serina y treonina), mediante un mecanismo de deshidratasa. La base de Schiff, una imina intermediaria, se hidroliza para formar el cetoácido y amoníaco.
- Catabolismo de aminoácidos
2.- Desaminación y transaminación de aminoácidos







No hay comentarios:
Publicar un comentario